El dolor abdominal es uno de los síntomas por el que con más frecuencia acude el paciente a Urgencias, constituyendo casi el 85% de las asistencias. La misión fundamental de los médicos que nos dedicamos a atender estas urgencias es establecer si un paciente tiene un abdomen agudo médico o quirúrgico y no como piensan muchos pacientes hacer un diagnóstico seguro de la causa de su dolor abdominal. De hecho, un 50% de los dolores abdominales que acuden a urgencias quedan al final sin diagnóstico y esto no supone ninguna negligencia médica ni suele conllevar problemas para el paciente. Otra cosa que aprendemos con los años de práctica es que hay muy poca correlación entre la intensidad del dolor y la gravedad del cuadro. De hecho, yo personalmente temo mucho mas al paciente que acude por dolor abdominal agudo, tiene mal aspecto y se queja poco que al que grita por su dolor como un condenado.
Ya he presentado en mas ocasiones casos clínicos de pacientes que acudieron al servicio de urgencias con dolor abdominal y hoy voy a presentar otro que atendí hace escasos días.
Se trata de una mujer de 50 años de edad, fumadora de 30 cigarrillos al día desde hacía 20 años y bebedora habitual de alcohol de forma no abusiva, sin antecedentes obstétricos de interés pero que se encontraba en el periclimaterio y había iniciado su ultima menstruación hacia una semana. Estaba a tratamiento de una posible enfermedad pulmonar obstructiva crónica por su Dr de primaria con un inhalador de broncodilatador. Acudía al servicio de urgencias por un cuadro clínico consistente en distensión abdominal en las últimas 72 horas que inicialmente atribuyó a gases y desde esa mañana dolor abdominal supraumbilical en barra que se había generalizado y que describía que se agudizaba con los movimientos y la flexión del tronco. Tuvo dos vómitos, no refería cambios del habito intestinal, fiebre ni sintomatología miccional.
En la exploración física la paciente se veía muy afectada por el dolor pero con aceptable estado general, afebril, normohidratada, con ligera palidez cutánea pero no conjuntival, bien perfundida y hemodinámicamente estable. No mostraba focalidades neurológicas groseras y se encontraba eupneica en reposo. No mostraba ingurgitación yugular a 45º y la auscultación cardiopulmonar era estrictamente normal. En la exploración orofaringea era llamativa una lengua velluda negra y la exploración del abdomen mostraba unos ruidos hidroaéreos normales pero la palpación y percusión eran casi imposibles por una tremenda defensa, incluso al roce. La puñopercusión renal izquierda era dudosamente positiva, pero me dejaba claro que el problema intrabdominal que no podía palpar ni percutir, era izquierdo. Los MMII no mostraban alteraciones de interés.
Loas análisis de sangre y orina de rigor mostraron los siguientes resultados
Análisis elemental de orina: Densidad 1.025 , Ph 5, Leucocitos ++, nitritos -, proteínas +, glucosa - cuerpos cetónicos ++++, urobilinógeno ++, bilirubina + y sangre +++++ Sedimento con 21-30 gr/campo, 1-3 leucos(campo, bacterias escasas, abundantes células epiteliales y moderada presencia de cilindros hialinos. Del hemograma unicamente destacaba un Volumen Corpuscular Medio de 100.5 fl, Hemoglobina Corpuscular Media de 35.6 pg y el resto de los parámetros estaban dentro de los rangos de la normalidad. El estudio de la coagulación era estrictamente normal, así como la glucemia, la función renal y los iones sodio y potasio, la función hepática y la amilasa. La amilasuria era sin embargo un poco elevada 484 U/L [0 - 460]
Estaba convencido de que no era un cólico renal lo que la paciente tenía y que la escasa presencia de sangre en la orina se debía a su reciente menstruación, tampoco me parecía el cuadro habitual de una pancreatitis, a pesar de la escasa elevación de la amilasa en orina (ni siquiera me planteaba estudiar la lipasa), pero no dudaba de que el abdomen era patológico y guardaba alguna sorpresa. No me gustaba nada el peritonismo, la marcadísima defensa de la paciente a la palpación abdominal y sobre todo el vacío izquierdo.
La radiografía simple del abdomen solamente me mostraba un perdigón
Ya he presentado en mas ocasiones casos clínicos de pacientes que acudieron al servicio de urgencias con dolor abdominal y hoy voy a presentar otro que atendí hace escasos días.
Se trata de una mujer de 50 años de edad, fumadora de 30 cigarrillos al día desde hacía 20 años y bebedora habitual de alcohol de forma no abusiva, sin antecedentes obstétricos de interés pero que se encontraba en el periclimaterio y había iniciado su ultima menstruación hacia una semana. Estaba a tratamiento de una posible enfermedad pulmonar obstructiva crónica por su Dr de primaria con un inhalador de broncodilatador. Acudía al servicio de urgencias por un cuadro clínico consistente en distensión abdominal en las últimas 72 horas que inicialmente atribuyó a gases y desde esa mañana dolor abdominal supraumbilical en barra que se había generalizado y que describía que se agudizaba con los movimientos y la flexión del tronco. Tuvo dos vómitos, no refería cambios del habito intestinal, fiebre ni sintomatología miccional.
En la exploración física la paciente se veía muy afectada por el dolor pero con aceptable estado general, afebril, normohidratada, con ligera palidez cutánea pero no conjuntival, bien perfundida y hemodinámicamente estable. No mostraba focalidades neurológicas groseras y se encontraba eupneica en reposo. No mostraba ingurgitación yugular a 45º y la auscultación cardiopulmonar era estrictamente normal. En la exploración orofaringea era llamativa una lengua velluda negra y la exploración del abdomen mostraba unos ruidos hidroaéreos normales pero la palpación y percusión eran casi imposibles por una tremenda defensa, incluso al roce. La puñopercusión renal izquierda era dudosamente positiva, pero me dejaba claro que el problema intrabdominal que no podía palpar ni percutir, era izquierdo. Los MMII no mostraban alteraciones de interés.
Loas análisis de sangre y orina de rigor mostraron los siguientes resultados
Análisis elemental de orina: Densidad 1.025 , Ph 5, Leucocitos ++, nitritos -, proteínas +, glucosa - cuerpos cetónicos ++++, urobilinógeno ++, bilirubina + y sangre +++++ Sedimento con 21-30 gr/campo, 1-3 leucos(campo, bacterias escasas, abundantes células epiteliales y moderada presencia de cilindros hialinos. Del hemograma unicamente destacaba un Volumen Corpuscular Medio de 100.5 fl, Hemoglobina Corpuscular Media de 35.6 pg y el resto de los parámetros estaban dentro de los rangos de la normalidad. El estudio de la coagulación era estrictamente normal, así como la glucemia, la función renal y los iones sodio y potasio, la función hepática y la amilasa. La amilasuria era sin embargo un poco elevada 484 U/L [0 - 460]
Estaba convencido de que no era un cólico renal lo que la paciente tenía y que la escasa presencia de sangre en la orina se debía a su reciente menstruación, tampoco me parecía el cuadro habitual de una pancreatitis, a pesar de la escasa elevación de la amilasa en orina (ni siquiera me planteaba estudiar la lipasa), pero no dudaba de que el abdomen era patológico y guardaba alguna sorpresa. No me gustaba nada el peritonismo, la marcadísima defensa de la paciente a la palpación abdominal y sobre todo el vacío izquierdo.
La radiografía simple del abdomen solamente me mostraba un perdigón
¡Pero que demonios! Eso solamente significa que a la paciente le gusta comer carne de caza y antes alguien no limpió bien la carne de perdigones.
Administré un poco de analgesia iv y avise al cirujano de guardia para exponerle el cuadro. Al cirujano de guardia tampoco le parecía ni una crisis renoureteral ni una pancreatitis, así que decidimos solicitar la ecografia y/o TAC abdominopelvico urgente, porque teníamos claro que había tomate importante en ese abdomen y no teníamos claro el que..
¡Ya estaba empezando a descerebrarme! El cuadro clínico que me contaba la paciente no iba con lo que me mostraba a mi exploración, las pruebas complementaras no me convencían de nada porque yo estaba absolutamente convencido del problema intrabdominal izquierdo y no a expensas de la vía urinaria y la paciente era mujer, lo que significaba que había que tener en cuenta posibles etiologias del cuadro de dolor que el varón no presenta. ¡Pues atentos, que por ahí van las cosas!
El radiologo realizó las pruebas de imagen, las interpretó en el contexto clínico e hizo el siguiente informe radiológico:
Administré un poco de analgesia iv y avise al cirujano de guardia para exponerle el cuadro. Al cirujano de guardia tampoco le parecía ni una crisis renoureteral ni una pancreatitis, así que decidimos solicitar la ecografia y/o TAC abdominopelvico urgente, porque teníamos claro que había tomate importante en ese abdomen y no teníamos claro el que..
¡Ya estaba empezando a descerebrarme! El cuadro clínico que me contaba la paciente no iba con lo que me mostraba a mi exploración, las pruebas complementaras no me convencían de nada porque yo estaba absolutamente convencido del problema intrabdominal izquierdo y no a expensas de la vía urinaria y la paciente era mujer, lo que significaba que había que tener en cuenta posibles etiologias del cuadro de dolor que el varón no presenta. ¡Pues atentos, que por ahí van las cosas!
El radiologo realizó las pruebas de imagen, las interpretó en el contexto clínico e hizo el siguiente informe radiológico:
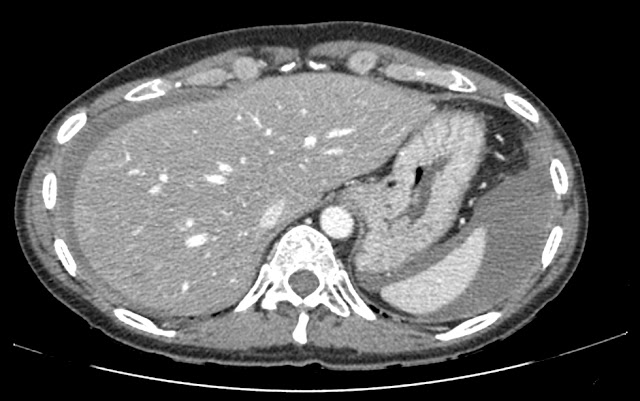
Cuerpo extraño en flanco derecho con marcados artefactos metálicos (perdigón?)
Esteatosis hepática con lesiones hipodensas en lóbulo hepático derecho. La de mayor tamaño se localiza en segmento VII, mide aprox. 2,7 cm y ecográficamente se corresponde con un quiste simple, pudiendo corresponder el resto lesiones con quistes aunque algunas de ellas por su pequeño tamaño no son posibles caracterizar definitivamente.
Líquido libre de moderada cuantía a nivel perihepático, periesplénico en ambas goteras paracólicas y en pelvis, identificando discreta alteración de la grasa en ambos hipocondrios y alguna pequeña lesión nodular, altamente sugestivo de carcinomatosis peritoneal.
El líquido localizado en ambas goteras paracólicas y en pelvis presenta una densidad alta en el rango del líquido complicado, que obliga a descartar hemoperitoneo.
¡Carmba! lo que teniamos delante era una masa pélvica de probable origen ovárico, probablemente un cáncer con signos que sugieren carcinomatosis peritoneal y hemoperitoneo con clínica de 4 días de evolución!
Esto merece un repaso del cáncer de ovario y la carcinomatosis peritoneal, así que allá vamos.
El Cáncer de Ovario representa el 18% de las neoplasias ginecológicas y afecta a más de 250.000 mujeres en el mundo, siendo responsable de la muerte de más de 140.000 mujeres cada año. La incidencia máxima de esta patología es a los 50 años de edad.
De todos los tumores malignos del ovario el 80% surgen del epitelio ovárico (cistadenocarcinomas serosos o mucinosos, tumores endometriodes similares al adenocarcinoma de endometrio, celioblastomas, tumores de Brener, carcinomas de células claras y carcinomas no clasificados) y el 20% restante se originan en las células germinativas o en el estroma (tumores de las células de Leydig-Sertoli, disgerminomas y teratomas malignos).
Los síntomas mas precoces de un cáncer de ovario son molestias vagas abdominales y problemas digestivos leves. La hemorragia endometrial no fisiológica es rara y presumiblemente sea el resultado de la secreción de hormona por parte del tumor. El dolo abdominal debido al aumento de tamaño o a la acumulación de líquido ascítico, el dolor pélvico, la anemia y la caquexia aparecen en una fase tardía del curso clínico, pero en el 70-80% de las pacientes que padecen un cáncer de ovario la enfermedad se extiende por la pelvis o fuera de ella antes del diagnóstico, debido a que un ovario puede crecer hasta un tamaño considerable antes de que aparezcan síntomas clínicos.
El cáncer de ovario tiende a diseminarse por extensión directa y linfática a los ganglios regionales de la pelvis y de la región paraaórtica. Con la afectación linfática hay habitualmente diseminación al peritoneo pélvico y abdominal. Un 75% de las pacientes con cáncer de ovario desarrollan carcinomatosis peritoneal durante el proceso de la enfermedad y según la Sociedad Española de Oncología Médica, hasta el 70 por ciento de los diagnósticos de cáncer de ovario en estadio III ya se presentan con carcinomatosis peritoneal.
En cerca del 82% de los casos de recidiva en un cáncer de ovario ya diagnósticado y tratado hay carcinomatosis peritoneal. Si el cáncer de ovario se encuentra en un estadio precoz el tiempo promedio de recidiva va de los 11 a los 29 meses y la carcinomatosis peritoneal es mucho mas frecuente que la extensión por los ganglios linfáticos retroperitoneales. Si el cáncer de ovario está en un estadio avanzado y el tratamiento inicial alcanzó una respuesta clínica significativa, el tiempo promedio de recidiva va de los 18 a los 24 meses y es de nuevo la carcinomatosis peritoneal la forma de extensión mas frecuente del cáncer.
El término carcinomatosis proviene del griego karkinoma; karki que significa cáncer y -oma que significa tumor. El término peritoneal proviene de la palabra peritonaion que significa "extenderse sobre". El concepto de carcinomatosis peritoneal hace referencia a la diseminación de un tumor maligno dentro de la cavidad abdominal. La carcinomatosis peritoneal es el proceso maligno que afecta con más frecuencia al peritoneo. En el 80% de las ocasiones los tumores que se extienden por el peritoneo son adenocarcinomas y se originan en órganos intrabdominales, siendo uno de ellos el ovario (otros son páncreas, colon, estómago y útero).
Se describen cuatro posibles mecanismos de diseminación tumoral a través del peritoneono excluyentes entre sí
¡Carmba! lo que teniamos delante era una masa pélvica de probable origen ovárico, probablemente un cáncer con signos que sugieren carcinomatosis peritoneal y hemoperitoneo con clínica de 4 días de evolución!
Esto merece un repaso del cáncer de ovario y la carcinomatosis peritoneal, así que allá vamos.
El Cáncer de Ovario representa el 18% de las neoplasias ginecológicas y afecta a más de 250.000 mujeres en el mundo, siendo responsable de la muerte de más de 140.000 mujeres cada año. La incidencia máxima de esta patología es a los 50 años de edad.
De todos los tumores malignos del ovario el 80% surgen del epitelio ovárico (cistadenocarcinomas serosos o mucinosos, tumores endometriodes similares al adenocarcinoma de endometrio, celioblastomas, tumores de Brener, carcinomas de células claras y carcinomas no clasificados) y el 20% restante se originan en las células germinativas o en el estroma (tumores de las células de Leydig-Sertoli, disgerminomas y teratomas malignos).
Los síntomas mas precoces de un cáncer de ovario son molestias vagas abdominales y problemas digestivos leves. La hemorragia endometrial no fisiológica es rara y presumiblemente sea el resultado de la secreción de hormona por parte del tumor. El dolo abdominal debido al aumento de tamaño o a la acumulación de líquido ascítico, el dolor pélvico, la anemia y la caquexia aparecen en una fase tardía del curso clínico, pero en el 70-80% de las pacientes que padecen un cáncer de ovario la enfermedad se extiende por la pelvis o fuera de ella antes del diagnóstico, debido a que un ovario puede crecer hasta un tamaño considerable antes de que aparezcan síntomas clínicos.
El cáncer de ovario tiende a diseminarse por extensión directa y linfática a los ganglios regionales de la pelvis y de la región paraaórtica. Con la afectación linfática hay habitualmente diseminación al peritoneo pélvico y abdominal. Un 75% de las pacientes con cáncer de ovario desarrollan carcinomatosis peritoneal durante el proceso de la enfermedad y según la Sociedad Española de Oncología Médica, hasta el 70 por ciento de los diagnósticos de cáncer de ovario en estadio III ya se presentan con carcinomatosis peritoneal.
En cerca del 82% de los casos de recidiva en un cáncer de ovario ya diagnósticado y tratado hay carcinomatosis peritoneal. Si el cáncer de ovario se encuentra en un estadio precoz el tiempo promedio de recidiva va de los 11 a los 29 meses y la carcinomatosis peritoneal es mucho mas frecuente que la extensión por los ganglios linfáticos retroperitoneales. Si el cáncer de ovario está en un estadio avanzado y el tratamiento inicial alcanzó una respuesta clínica significativa, el tiempo promedio de recidiva va de los 18 a los 24 meses y es de nuevo la carcinomatosis peritoneal la forma de extensión mas frecuente del cáncer.
El término carcinomatosis proviene del griego karkinoma; karki que significa cáncer y -oma que significa tumor. El término peritoneal proviene de la palabra peritonaion que significa "extenderse sobre". El concepto de carcinomatosis peritoneal hace referencia a la diseminación de un tumor maligno dentro de la cavidad abdominal. La carcinomatosis peritoneal es el proceso maligno que afecta con más frecuencia al peritoneo. En el 80% de las ocasiones los tumores que se extienden por el peritoneo son adenocarcinomas y se originan en órganos intrabdominales, siendo uno de ellos el ovario (otros son páncreas, colon, estómago y útero).
Se describen cuatro posibles mecanismos de diseminación tumoral a través del peritoneono excluyentes entre sí
- Diseminación directa a las estructuras peritoneales adyacentes al tumor primario.
- Diseminación linfática.
- Metástasis embólicas.
- Siembra intraperitoneal a través del líquido ascítico.
El movimiento fisiológico del liquido ascítico dentro de la cavidad abdominal está condicionado por la fuerza de la gravedad, que lo dirige en sentido caudal y por la presión negativa generada en el tórax durante la respiración, que lo dirige en sentido ascendente, lo que condiciona que las localizaciones más frecuentes de los implantes peritoneales sean la pelvis, el cuadrante inferior derecho del abdomen en la inserción de la raíz mesentérica, la región superior del colon sigmoides y la gotiera parietocólica derecha.
El TAC abdominopélvico con contraste es la prueba diagnóstica de elección para el diagnóstico de carcinomatosis peritoneal siendo además una herramienta imprescindible para el estadiaje prequirúrgico y la planificación del tratamiento, pero ninguno de los hallazgos radiológicos es patognomónico. La ascitis neoplásica es un hallazgo frecuente pudiendo ser tanto muy abundante como tratarse de un hallazgo sutil. La existencia de ascitis loculada obliga a descartar una carcinomatosis. Los implantes pueden ser lesiones sólidas, quísticas, mixtas y/o calcificadas que pueden manifestarse como nódulos, masas, placas y lesiones infiltrantes. Los implantes de localización subcapsular en el hígado y bazo originan la apariencia "festoneada" de su superficie. La infiltración del omento asociada a una reacción fibrosa da lugar al llamado "epiplón en torta" ("omental cake", "floating cake"), la infiltración difusa del mesenterio puede dar lugar a un "mesenterio estrellado" y la infiltración difusa del peritoneo visceral de un asa de intestino delgado origina el llamado "aspecto en teca" que puede condicionar obstrucción intestinal ("íleon congelado").
En el diagnóstico diferencial de la carcinomatosis hay que considerar
Las mujeres con una masa y dolor pélvico y un adenocarcinoma difuso por toda la cavidad peritoneal pero sin una localización clara de origen, lo que tienen es un carcinoma seroso papilar peritoneal primario.
Cuando yo era estudiante de medicina la carcinomatosis peritoneal se consideraba una situación "terminal" y tenía un pronóstico deplorable con una supervivencia menor de seis meses, por lo que los pacientes se consideraban prácticamente desahuciados. El tratamiento con quimioterapia sistémica y las medidas de soporte y cuidados paliativos no aportaban ninguna esperanza de curación y la cirugía de “resección incompleta” conducía a recidivas, reaparición de masas tumorales, complicaciones tales como la obstrucción intestinal, fistulas, etc. con la necesidad de reintervenciones múltiples, programadas o de urgencia que conduían indefectiblemente al deterioro progresivo del estado general, pérdida de peso, aumento de las molestias abdominales y finalmente al desenlace fatal.
Pero en la actualidad hay un cambio de actitud respecto a lo que representa una carcinomatosis peritoneal interpretando que el peritoneo actúa como una barrera que “detiene” la progresión tumoral cuyos implantes quedan limitados a la cavidad peritoneal constituyendo por lo tanto la Carcinomatosis peritoneal un “estadio locorregional” de la enfermedad, susceptible de tratamiento con intención curativa.
Desde 1982, el Dr. Sugarbaker del Washington Cancer Institute, planteó la diseminación peritoneal como un estadio locorregional de la enfermedad y desarrolló una nueva alternativa terapéutica basada en el tratamiento de la enfermedad macroscópica mediante cirugía citorreductora radical oncológica merced a las peritonectomías por él desarrolladas, seguido del tratamiento de la enfermedad residual microscópica con la aplicación de quimioterapia hipertérmica (42º C) intraperitoneal intraoperatoria (en sus siglas en inglés HIPEC). Esta consideración de la enfermedad como un estadio locorregional ha permitido que se planteen nuevas opciones terapéuticas en determinados pacientes. La combinación de cirugía de citorreducción y la aplicación de quimioterapia hipertérmica intraoperatoria consigue una supervivencia del 40% a los 5 años y una mejoría calidad de vida y la supervivencia media del 85% en las pacientes con carcinomatosis peritoneal por cáncer de ovario (estadios III C – IV). Las contraindicaciones son: la enfermedad extra-abdominal, metástasis a distancia, no resecables, insuficiencia respiratoria, insuficiencia renal, enfermedad cardiovascular, edad superior a 70 años.
Dr. Paul Sugarbaker
Paul Sugarbaker nació el 28 de noviembre de 1941 en Baltimore. Asistió a la Escuela media en Jefferson City (Missouri) hasta 1959 y posteriormente estudió en el Wheaton College en Illinois, licenciandose en 1963. En 1967 entra en el Medical College de la Universidad de Cornell y se doctora en Medicina continuando su Formación en el Hospital Peter Bent Brigham de Boston (Internship 1967/68, Residency 1968 hasta 1973, Jefe de residentes, en 1973) De 1973 a 1976, investigó en el Hospital General de Massachusetts. Posteriormente le nombran Jefe del Instituto Nacional del Cáncer en Bethesda (Maryland) y cirujano jefe de cáncer de Colon, Cirugía de 1986 a 1989. A partir de 1989 es nombrado Director de Oncología quirúrgica en la Emory University Medical School y Director Médico del Washington Cancer Institute y el MedStar Washington Hospital Center. A partir de 1993 es nombrado Director de Oncología quirúrgica. En 1983, recibe una maestría en inmunología de la Universidad de Harvard. Es Fellow de la Royal College of Surgeons of England y del Royal College of Physicians and Surgeons of Glasgow y miembro Fundador de la International Society of Regional de la Terapia del Cáncer. Sugarbaker recibió el Premio por Servicios Distinguidos de la American Society of Abdominal Surgeons. Es Coeditor de la revista European Journal of Surgical Oncology.
La alta complejidad técnica, curva de aprendizaje y necesidad de recursos asistenciales de esta técnica, requiere idealmente una concentración en centros de referencia que cuenten con cirujanos con un interés y dedicación preferencial a esta patología, una formación específica y una experiencia clínica contrastada, además de una experiencia y conocimiento profundos de la enfermedad para poder seleccionar a los pacientes adecuados, por ello en España nació la GECOP, el Grupo Español de Carcinomatosis Peritoneal.
Los pacientes que no responden de manera efectiva a la quimioterapia sistémica convencional y no cumplen criterios para someterse a una cirugía citorreductora son candidatos a beneficiarse de la PIPAC (Pressurized Intraperitoneal Aerosol Chemotherapy) quimoterapia intraperitoneal con aerosoles presurizados través de laparoscopia.
En 2012, Marc Reymond y sus colaboradores propusieron, en un modelo animal, un enfoque novedoso para la administración intraperitoneal de medicamentos, durante el cual la quimioterapia se administra como un aerosol durante el neumoperitoneo con CO2. El aerosol es generado por una línea de alta presión conectada a una boquilla, de ahí el término quimioterapia en aerosol intraperitoneal a presión o PIPAC. Los estudios realizados y los resultados clínicos obtenidos en humanos apuntan que esta técnica puede convertirse en un tratamiento de alta eficacia porque permite reducir el volumen del tumor dando opción a practicar posteriormente una cirugía citorreductora o bien, como tratamiento paliativo en aquellos casos donde la cirugía no sea viable como en casos no operables de carcinomatosis peritoneal. Se considera un tratamiento paliativo que ofrece buenos resultados clínicos en calidad de vida.
Recientemente, el mismo grupo propuso combinar la nebulización de la quimioterapia con la precipitación electrostática utilizando el sistema Ultravision originalmente desarrollado para eliminar el humo del campo operatorio laparoscópico mediante una fuerza electrostática. En teoría, la combinación de precipitación electrostática con PIPAC, denominada ePIPAC, podría resultar en una mejor penetración del aerosol en el tejido.
Un posible inconveniente Tanto de PIPAC como de (e) PIPAC, es el desafío de administrar un aerosol de quimioterapia de manera segura por vía intraperitoneal durante la laparoscopia, mientras se evita la exposición de los trabajadores de la salud involucrados.
Marc A. Reymond nació en 1959. Se graduó como médico de La Universidad de Ginebra, Suiza. Ha trabajado en la Universidad Católica de Lovaina (Bélgica) y en la Universidad de Erlangen (Alemania). De 1995 a 1999 fue líder del grupo de investigación en oncología quirúrgica en la Fundación para la Investigación Médica de la Universidad de Ginebra, Suiza. En 1998 se convirtió en profesor asociado de Cirugía en la Universidad de Ginebra. En 1999, se convirtió en jefe de cirugía colorrectal y vicepresidente. Ha sido Presidente del Departamento de Cirugía de la Universidad de Magdeburgo, Alemania. Del 2005 al 2011 fue presidente y jefe del departamento de Cirugía en el Hospital Evangélico de Bielefeld, un hospital de más de 1500 camas. De abril 2012 a junio de 2016, fue Vicepresidente y Jefe de Oncología Quirúrgica en el Ruhr-Universidad de Bochum, donde desarrolló la técnica de admonistración de quimioterapia con aerosol intraperitoneal a presión (PIPAC).
Dr. Marc A. Reynold
En julio de 2016, el Dr. Reymond se trasladó a la Universidad de Tübingen como Jefe del Centro Nacional de Pleura y Peritoneo (NCPP). En 2002 completó un MBA en Ciencia y Tecnología con la Universidad LaSalle, Filadelfia, Estados Unidos. Es el fundador de dos empresas de biotecnología y de un biobanco sin fines de lucro. Es el editor Jefe de "Pleura y Peritoneo" y un experto asesor del Primer Ministro francés y del Ministro de Investigación. Es profesor de cirugía en la Universidad de Magdeburgo y en la Universidad de Tübingen, Alemania. Hoy en día está casado y es padre de 5 hijos.







Enhorabuena por el magnífico trabajo. Saludos.
ResponderEliminarhttps://foto-natura-huesca.blogspot.com/
Muchas gracias Miguel Angel
ResponderEliminar