En
la última guardia entre otros pacientes, he atendido a un niño de
11 años de edad sin antecedentes medicoquirurgicos de interés que
había sido arroyado por un trineo cayendo sobre su hombro derecho.
El pobre estuvo todo el día aguantando un terrible dolor de hombro
sin decir ni mu hasta que casi entrada la noche lo trajeron al
servicio de urgencias. El pobre rapaz estaba tan serio que llamaba
poderosamente la atención, hasta que al explorar su hombro entendí
lo que pasaba. Una radiografía confirmó mi diagnóstico clínico:
una tremenda fractura de tercio medio clavicular.
Decidí
aprovechar este caso, para escribir hoy sobre las fracturas
claviculares, así que aquí va el resumen.
Introducción:
Un poco de historia y epidemiologia de la fractura clavicular
Las
fracturas de la clavícula se conocen y se han documentado desde los
albores de la humanidad. Posiblemente la primera referencia médica
escrita que se conozca de la fractura de la clavícula sea el caso 35
del papiro The Edwin Smith Papyrus (ya hablé de este documento médico del antiguo Egipto cuando traté el TCE), que dice así:
"Si
examinas a un hombre que tiene una ruptura en el hueso del cuello,
debes encontrar el hueso del cuello corto y separado de su compañero.
Dirás: lo trataré. Colócalo postrado sobre su espalda con algo
doblado entre los omóplatos; deberías separarte con sus dos hombros
para estirar el hueso hasta que la fractura caiga en su lugar ".
Posteriormente
Hipócrates ya describe como es la fractura de la clavícula y
preconiza su tratamiento conservador, no sin lamentarse de que es un
tipo de fractura que al principio duele mucho y preocupa al paciente
pero al poco tiempo deja de doler y como permite al paciente moverse
y comer por si mismo, hace que este se despreocupe y después la
curación es lenta y deja malos resultados.
Las
fracturas de la clavícula representan hasta un 10-16% (hay quien
dice que solo el 2,6%) de todas las fracturas y el el 44% de todas
las fracturas de la cintura escapular. Su distribución anatómica es
entre el 69 y el 81% diáfisis, 2-4% tercio medial y 10-15% tercio
lateral. Es una fractura frecuente en jóvenes, predominando en el
varón.
El
mecanismo de lesión más frecuente (94%) lo constituyen los
traumatismos directos sobre el hombro en las caídas (en muchas
ocasiones por traumatismos de alta energía), seguido por los
traumatismos indirectos por caída sobre la mano extendida.
El
trazo de fractura suele ser oblicuo en la mayoría de las ocasiones.
El desplazamiento de los fragmentos suele estar influido por las
inserciones musculares en la clavícula: el fragmento proximal se
desplazaría hacia arriba y posterior por acción del
esternocleidomastoideo, mientras que el fragmento distal es
traccionado había abajo y anterior por acción del pectoral mayor y
del deltoides.
Clasificaciones
de la fractura clavicular
Como
es habitual con las fracturas, los traumatólogos a lo largo de la
historia han hecho varias clasificaciones de esta fractura.
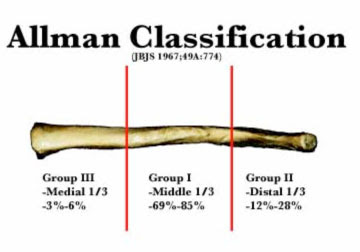
Lo primero que hay que decir de estas
clasificaciones es que todas parten de una primera realizada en 1967
por Alman y que divide la fractura de la clavícula en tres
tipos según su localización, diafisaria, lateral o medial, para ir
añadiendo subtipos.
Un
esquema sería el siguiente
La
clasificación de Neer (1968) añade los siguientes
subtipos a la fractura lateral (Tipo II)
-
Tipo I: Con los ligamentos coracoclaviculares intactos.
-
Tipo II: Con lesión de los ligamentos coracoclaviculares.
-
Tipo III : Con fractura-arrancamiento de la placa coracoidea.
Charles
S. Neer nació el 10 de noviembre de 1917 y murió el 28 de
febrero de 2011 en Vinita, Oklahoma, EE. UU. Hijo
y nieto de médicos, estudió en el Dartmouth College, en la Facultad
de Medicina de la Universidad de Pensilvania y en el Centro Médico
Presbiteriano de Columbia. Se convirtió en Profesor Emérito,
culminando en una impresionante carrera académica. Fue cirujano en
el ejército de los Estados Unidos durante la Segunda Guerra Mundial,
estando en Europa, Japón y Filipinas. Después de la guerra, regresó
a la Universidad de Columbia, donde se convirtió en jefe del
Servicio de Fracturas, y posteriormente del Servicio de Ortopedia
para Adultos. En 1955, comenzó la transformación más grande jamás
vista en cirugía de hombro con la introducción de la artroplastia
parcial. En 1969 presidió la Junta Directiva de la AAOS y la AOA,
simultáneamente.
La
clasificación Craig (1990) añade 5 subtipos a la
fractura distal o Tipo II
a.
Minimamente desplazada
b.
Desplazada
fractura medial a los ligamentos CC
1. Conoide y trapezoide intactos
2. Rotura del conoide, trapezoide intacto
c.
fracturas de la superficie articular
d.
fracturas en niños,
los ligamentos CC intactos unidos al periostio y el fragmento
proximal desplazado
e.
Fracturas comminutas
y
otros tantos a la Tipo III o medial
a.
Mínimo desplazamiento
b.
Desplazadas
c.
Intrarticular
d.
Fractura de la epifisis
e.
Comminutas
E V Craig es un cirujano ortopédico americano que obtuvo su título de médico en el Columbia College of Physicians and Surgeons. Hizo su residencia en el departamento médico del Presbyterian Hospital de New York, en el departamento de cirugía del Roosevelt Hospital de New York y en el New York Orthopedic Hospital. Es Chief Executive Officer del TRIA Orthopaedic Center, Professor of Orthopaedic Surgery, en la Universidad de Minnesota, Minneapolis, Former Attending Orthopedic Surgeon en el Hospital for Special Surgery de New York, y Former Professor of Clinical Orthopaedic Surgery, del Weill Medical College, de la Universidad de Cornell de New York. Entre sus cargos forma parte del Consejo de Administración de la Revista Journal of Shoulder and Elbow Surgery. También formo parte del Consejo de administración de la American Academy of Orthopaedic Surgeons de 1992 a1993 y Presidente de la American Shoulder and Elbow Surgeons en 1996.Además tiene el bachillerato en Arte por la Universidad de Princeton y un master en salud pública de la Universidad de Columbia.
La
clasificación Robinson (1998) hace las siguientes subdivisiones
Tipo
1: tercio proximal 1/5 de las fx de clavícula
a.
No desplazadas
a1. Extra-articular
a2. Intra-articular
b.
Desplazadas
b1. Extra-articular
b2. Intra-articular
Tipo
2: tercio medio 3/5 de las fx de clavícula
a.
Fx alineadas según la cortical
a1. No desplazadas
a2. Anguladas
b.
Desplazadas
b1. Simple, tercer fragmento
b2. Multifragmentario, comminuta
Tipo
3: tercio lateral 1/5 de las fx de clavícula
a.
No desplazadas
a1. Extra-articular
a2. Intra-articular
b.
Desplazadas
b1. Extra-articular
b2. Intra-articular
Christopher
Michael Robinson es cirujano ortopédico consultor en la Royal
Infirmary of Edinburgh desde 1997 y tiene una Clínica Especializada
en Miembros Superiores en El área de Lothian. La Unidad tiene
reputación internacional de excelencia clínica y logros académicos
y es centro de referencia para pacientes con lesiones en los miembros
superiores.
La
clasificación de la AO/OTA
Clínica
de la fractura de clavícula
En
lo que respecta a la clínica, el paciente suele encontrarse con el
hombro afectado descendido y con el brazo pegado al cuerpo y renuente
a moverlo y en muchas ocasiones la cabeza adopta una posición
tendete a aliviar la tensión de la musculatura que se inserta en la
clavícula contribuyendo a la deformidad.
A la
exploración física es típico el signo de la tecla de piano, con
crepitación en la zona fracturada, que se debe a que el extremo
medial de la fractura se desplaza hacia arriba al ser traccionado por
los músculos esternocleidomastoideo y trapecio. Es conveniente
explorar las articulaciones esternoclavicular y acromioclavicular así
como la escápula y la extremidad superior del mismo lado por la
posibilidad de lesiones asociadas.
La
evaluación clínica debe establecer la permeabilidad de los vasos
subclavios. La presencia de pulso asimétrico, de frémito o de
hematoma pulsatil obligan a una evaluación vascular ulterior.
Hay
que auscultar el tórax para excluir una lesión apical pulmonar, así
como un examen neurológico minucioso para identificar cualquier
déficit existente que implique una plexopatía braquial.
Pruebas
diagnósticas
Entre
las pruebas complementarias para hacer el diagnóstico una proyección
radiológica anteroposterior suele ser suficiente, aunque si queremos
ver el patrón de la fractura o el desplazamiento necesitaremos una
radiografía apical oblicua. En caso de lesión cercana a la
articulación acromio-clavicular es útil realizar una radiografía
AP en carga, para descartar lesión a ese nivel. En caso de fracturas
mediales puede ser necesaria una TAC para valoración del grado de
desplazamiento posterior.
Tratamiento
El
tratamiento es generalmente conservador, no siendo precisa la
reducción en la mayoría de los casos, pero en caso de ser necesaria
se realiza por tracción de los hombros hacia atrás con
contra-tracción con la rodilla del examinador. Lo que se hace es
una inmovilización simple con cabestrillo o con vendaje en 8,
durante 4 semanas. Hay diferentes tipos de vendaje para esta
fractura pero el mas conocido y posiblemente mas utilizado ha sido el
vendaje de Velpeau. Otros de los vendajes conocidos son los de
Braatz, Sayre, o Watson-Jones.
Alfred Armand Louis Marie
Velpeau Nació el 18 de mayo de 1795 en la villa de Touraine,
Breches, Francia, en el seno de una familia humilde de padre herrero.
Aprendió a leer en latín y
escribir con el cura de la parroquia. De joven invirtió sus
ganancias recolectando y vendiendo nueces en comprar dos libros de
medicina que aprendió de memoria para comenzar a tratar a los
campesinos del lugar y dejando boquiabierto al médico de la comarca.
Comenzaría a estudiar e la casa de un terrateniente al que le curó
una hija para posteriormente tomar como maestro al cirujano del
hospital de Tours quien le pondría luego en contacto en 1816 con el
Dr. Fidele Bretonneau, cuando Velpeau tenía 21 años de edad.
Estudió cuatro años con él como maestro haciendo entre otras cosas
autopsias, disecciones y practicas de cirugía con los cadáveres del
cementerio del lugar, para lo cual escalaban su muro a las dos de la
madrugada. En 1819 es nombrado «oficial de salud» y su tutor lo
obliga a continuar sus estudios de medicina. En abril de 1820, a sus
25 años de edad, marcha a París donde obtendrá gracias a un premio
en Anatomía y Fisiología una plaza en el Hospital «San Luis». En
1823 es «Agregado en medicina» y escribe con Laennec su tesis sobre
la fiebre intermitente y crónica.
En 1828 obtiene con honores
el más alto nivel en Cirugía y es nombrado cirujano del Hospital
«La Pitie». Cinco años después, a sus 38 años, obtiene por
concurso la Cátedra de Cirugía de la Universidad de París. En 1832
fue elegido en la Academia de Medicina y en 1834 en la de Cirugía.
Durante 33 años se mantuvo al frente de su cátedra hasta su muerte
el 24 de agosto de 1867, provocada por una gripe y una prostatitis
aguda. Se cuenta que en su lecho de muerte murmuró: «Uno no debe
ser ocioso, es necesario trabajar siempre». Como curiosidad os diré
que Velpeau era enemigo acérrimo de la anestesia con éter o
cloroformo, a los que consideraba “agentes terribles”.
Sin
embargo también hubo quien preconizó la movilización precoz en la
fractura clavicular. Me refiero a Just Lucas-Championnière estudió
quien en 1895 publicó su “Traitement des fractures par le massage
et la mobilisation”. Primero aplicó esta idea a las fracturas de
radio y posteriormente a las de la clavícula, húmero y miembros
inferiores.
Just-Marie-Marcellin
Lucas-Championnière nació el 15 de agosto de 1843 en St.
Leonard, Oisi, Francia. Sabemos de el que estudió medicina siendo
interno de los Hospitales de París en 1865 y que se doctoró en
1870. A partir de 1874 se hizo cirujano tras publicar su tesis "De
la fièvre traumatique".
Durante
las vacaciones de 1866 marchó a Glasgow para conocer de primera mano
la nueva doctrina antiséptica de Lister que rápidamente adoptó. En
1869 Championnière publicó sus primeras impresiones en un trabajo
titulado 'Emploi de la méthode antiseptique en Chirurgie' que
apareció en el número de enero del Journal de Médecine et de
chirurgie pratiques. Entre 1869 y 1879 se dedicó a propagar la
cirugía antiséptica por toda Francia. En 1876 Baillière et fils
publicó su libro Chirurgie antiseptique: principes, modes
d'application et résultats du pansement de Lister, en París,
Glasgow y Madrid.
El
tratamiento quirúrgico de la fractura de la clavícula está
indicado en fracturas del 1/3 externo con lesión de ligamentos
acromioclaviculares, fracturas abiertas, fracturas con lesión
vascular o neurológica asociada, fracturas asociadas del cuello
glenoideo y fracturas bilaterales en paciente con insuficiencia
respiratoria. Lo que se hace es una osteosíntesis, para lo cual se
han utilizado, diferentes tipos de agujas, tornillos y placas (clavo
de Stenmann, clavos de Knowles, aguja de Kirstchner). En 1945 en
España, Dr.Hernández Ros publicó sus resultados utilizando un clavo
endomedular siguiendo el ejemplo que el americano Murray, publicó en
el Journal of Bone and Joint Surgery en 1940 en el que trataba 5
casos de fractura clavicular colocando un alambre intramedular guiado
por radioscopia a través del fragmento interno, haciendo una
incisión próxima al esternón .
Antonio
Hernández-Ros y Codorniu nació en Murcia en el año 1896.
Fue
médico del Hospital Provincial de la capital murciana y pasó, en
1926, a ser Jefe de la Sala de Cirugía, dedicándose desde entonces
por entero a la especialidad de Huesos y Articulaciones, que por
aquellas fechas se independizaba de la Cirugía General al crearse la
Sociedad Española de Cirugía Ortopédica y Traumatología, de la
que fue miembro fundador y su presidente desde 1953 hasta 1957.
Académico de la Real Academia de Medicina de Murcia desde 1930,
miembro emérito de la Sociedad Internacional de Cirugía Ortopédica
y Traumatología, miembro de honor de la Sociedad Ibérica de
Biomecánica, pasó por numerosas jefaturas de los Servicios de
Ortopedia y Traumatología para terminar en la Jefatura, obtenida por
oposición, de ese Servicio en el Gran Hospital del Estado de Madrid,
cargo que ocupó hasta su jubilación en 1967. Falleció en Madrid el
4 de Junio de 1982 a la edad de 86 años.